测试现场 - 解决方案形成
1.解决方案概念和特点
[注意] ①均匀稳定的液体不一定是溶液,如水。②溶液并非总是无色的,如蓝色硫酸铜溶液、浅绿色氯化亚铁溶液。③溶液中未溶解的部分不能视为溶质。④溶液质量=溶质质量、溶剂质量、溶液体积≠溶质体积、溶剂体积。
2.物质溶解时的吸收和放热现象。
物质溶解时,通常伴随着吸热和放热现象。如果硝酸铵溶解,会吸热,说明溶液温度降低;氢氧化钠溶解时放出热量,说明溶液温度升高。
【注意】氧化钙遇水也放出大量热量,但这个过程不是溶解放热,而是氧化钙与水反应放出大量热量。
3.乳化
植物油中加入去垢剂后,植物油分散成无数细小的油滴,但不能凝聚成大油滴。这种现象称为乳化。肥皂、洗发水等都有乳化作用。
【注意】乳化不同于溶解。乳化是将不溶性液体物质分散成微小的液滴,而溶解是将可溶性物质分散成分子、离子等。
2.测试点的饱和和不饱和溶液
1.概念:在一定温度下,在一定量的溶剂中加入一定量的溶质。当溶质不能继续溶解时,所得溶液称为溶质的饱和溶液;能继续溶解的溶液称为溶质的不饱和溶液。
【注意】在某种物质的饱和溶液中,该物质不能继续溶解,但也能溶解其他物质,如氯化钠在饱和硝酸钾溶液中。
3.水晶
冷却热饱和溶液(冷却结晶):冷却析出溶质。适用于溶解度随温度升高而变化较大的物质,如硝酸钾。
溶剂的蒸发(浓缩结晶):通过蒸发溶剂使溶质沉淀。适用于溶解度受温度影响较小的物质,如氯化钠。
三个测试点溶解度和溶解度曲线
1.固体溶解度
(1)定义:在一定温度下,固体物质在100g溶剂中达到饱和时的溶解质量。
(2)影响因素:溶质种类、溶剂种类、温度(大部分固体物质的溶解度随温度升高,如硝酸钾;少数固体物质的溶解度受温度变化影响很小_,如如氯化钠;一些固体物质的溶解度随温度升高而降低,如熟石灰)。
3.溶解度曲线
(1)定义:物质溶解度随温度变化的曲线称为溶解度曲线。
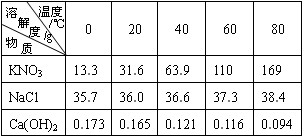
(2)应用:找出物质在一定温度下的溶解度;判断物质的溶解度随温度的变化趋势;比较不同物质在同一温度下的溶解度或同一物质的溶解度在不同的温度下。
4.水晶
(1)定义:在一定条件下,溶解在溶液中的物质以晶体的形式从溶液中析出。这个过程称为结晶。
(2)方法:蒸发结晶一般用于溶解度不受温度影响的物质;冷却结晶一般用于溶解度受温度变化影响较大的物质。
1.[常州, 2019] 下列哪种物质在水中能形成溶液是()
形容词(缩写)蔗糖 b. 粉笔灰
碳(简称)面粉 d.植物油
【分析】蔗糖溶于水形成均匀稳定的混合物,即为溶液;粉笔灰、面粉和植物油不溶于水,与水混合形成不均匀且不稳定的混合物。
2.将以下物质放入水中可以显着降低液体的温度()
形容词(缩写)CaO B.NaOH
碳(简称)浓丁基硫酸铵硝酸
3.【海南,2019】某实验组进行了物质溶解实验。在 20°C 下,称取 2.5g、5.0g 和 7.5g 固体氢氧化钠放入三个小烧杯(均装满 50ml 水)中,使其完全溶解。通过数字实验测量它们溶解过程中溶液温度的变化,如图3-1所示。
根据这个实验,你能得出什么关于 NaOH 在水中溶解的实验结论?
(写两点,请举例回答)。
示例: 证据:所有曲线都在上升。结
开:NaOH 溶解在水中时会放热。
【答案】①证据:2.5g氢氧化钠溶于水时,温升最小,7.5g氢氧化钠溶于水时,温升为最大的。结论:同等条件下,氢氧化钠溶解越多,放出的热量也越多。②证据:7.5g氢氧化钠在20°C的50mL水中可以完全溶解。结论:氢氧化钠易溶于水(合理)。
4.【2019青岛】以下与洗涤有关的做法是不合理的()
形容词(缩写)用洗涤剂清洗盘子上的油渍。
B. 用汽油洗掉衣服上的油渍。
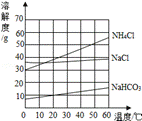
碳(碳的缩写)用白醋清洗釜内的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
d。用碱性溶液清洗铁制品表面的锈迹。
【解析】洗碗液具有乳化作用,可以去除餐具上的油渍。a是正确的;汽油能溶解油渍,洗去衣服上的油渍,b正确;白醋中的醋酸可将水垢中的碳酸钙和氢氧化镁转化为可溶性钙镁化合物,从而去除水垢。c是正确的;是碳酸钠,碳酸钠溶液不与锈发生反应,所以不能去除铁制品表面的锈。d错了。
5.【济宁,2018】为了探索物质溶解过程中的能量变化,有同学设计了如图3-2ⅰ所示的装置。将装有饱和硝酸钾溶液的试管放入盛满水的烧杯中,在水中加入足量的物质X,并搅拌。结合图2中硝酸钾的溶解度曲线,推断硝酸钾溶液的变化是合理的()
①X为NaCl固体,试管内无结晶析出,硝酸钾溶液仍为饱和溶液。
②X为NaOH固体,试管内无结晶析出,硝酸钾。
溶液仍然饱和。
(3) X是晶体,试管中有晶体沉淀,硝酸
钾溶液仍然是饱和溶液。
④X为浓硫酸,试管内无结晶析出,硝酸钾溶液。
是不饱和溶液。
形容词(缩写)①②③ B.①③④ C.①②④ D.②③④
【分析】通过溶解度曲线分析可知,硝酸钾的溶解度随温度升高而增大。X NaCl为固体,易溶于水,溶液温度基本恒定,故试管内无结晶析出,硝酸钾溶液仍为饱和溶液;大,试管内无晶体析出,硝酸钾溶液为不饱和溶液;晶体易溶于水,溶液温度降低,硝酸钾溶解度降低,试管内有晶体析出,硝酸钾溶液仍处于饱和状态。x为浓硫酸,易溶于水,溶液温度升高,硝酸钾溶解度增加,
6.[德州,2019]如图3-3所示,X和Y固体物质的溶解度曲线。下列说法正确的是()
形容词(缩写) 当温度低于 t2°C 时,物质 Y 的溶解度小于 x。
BX 和 Y 的溶解度随温度升高而增加。
碳(缩写)点a表示x和y的溶液在t1°C时是不饱和的
DY饱和溶液冷却后,溶质的质量分数保持不变。
【解析】本题考查溶解度曲线的应用。从图中可以看出,当温度低于t2℃时,Y的溶解度大于X的溶解度,所以A是错误的;X的溶解度随着温度的升高而增加,Y的溶解度随着温度的升高而升高而降低,所以B是错误的;A点在X的溶解度曲线之上,在Y的溶解度曲线之下,所以A点代表t1℃时X的饱和溶液和Y的不饱和溶液,所以C是错误的;y的溶解度随着温度的降低而增加,所以y的饱和溶液在温度降低后变成不饱和溶液,溶质质量分数不变,所以d是正确的。
我是超人老师,每天为大家更新中小学信息。如果你感觉很好,请记住我。